|
|
CURSO DE BIOLOGÍAAlejandro Porto Andión |
|
|
|
|
|
|
|
Inicio Temas de Microorganismos Aula virtual |
|
|
|
|
TEMA 21: INMUNIDAD.
1.- INTRODUCCIÓN.
 Una parte significativa de los microorganismos de nuestra
biosfera son parásitos de otros organismos y muchos de ellos tienen
además carácter patógeno y originan enfermedades en los organismos
parasitados. Para defenderse de ellos, los animales han desarrollado a
lo largo de su evolución biológica una serie de mecanismos defensivos
que constituyen el sistema inmunitario. El área de la ciencia
biológica que se ocupa de este conjunto de mecanismos defensivos se
denomina inmunología.
Una parte significativa de los microorganismos de nuestra
biosfera son parásitos de otros organismos y muchos de ellos tienen
además carácter patógeno y originan enfermedades en los organismos
parasitados. Para defenderse de ellos, los animales han desarrollado a
lo largo de su evolución biológica una serie de mecanismos defensivos
que constituyen el sistema inmunitario. El área de la ciencia
biológica que se ocupa de este conjunto de mecanismos defensivos se
denomina inmunología.
Aunque la inmunología surgió y se desarrolló como ciencia sólo en los dos últimos siglos, de la mano de la microbiología, sus antecedentes históricos se remontan ya a la Grecia clásica. Así, el historiador Tucídides (464-404 a.C.) relata que durante las guerras del Peloponeso los soldados aquejados de una cierta enfermedad eran atendidos solamente por aquellos compañeros que ya la habían sufrido, en el convencimiento de que éstos estaban de algún modo protegidos frente a ella. Asimismo, en la China del siglo XI a.C. se había constatado que la inhalación de polvo procedente de escaras de la viruela protegía frente a esa enfermedad. Esta práctica fue introducida en Europa durante el siglo XVIII por Lady Mary Wortley Montagu, esposa del embajador británico en Constantinopla, tras probar sus resultados experimentando, de manera muy poco rigurosa, con un grupo de prisioneros de guerra.
El primer estudio riguroso acerca de las defensas naturales frente a las enfermedades infecciosas fue el del médico inglés Edward Jenner (1749-1823). Jenner observó que las vacas se veían afectadas por una enfermedad con síntomas similares a la viruela y que la transmitían a humanos en una forma benigna, la “viruela vacuna”, la cual sólo producía pústulas en las manos a las personas que las manipulaban, y no en todo el cuerpo como ocurría con la viruela humana. En 1798 Jenner (Figura 2.1) inyectó a un niño pus procedente de una pústula de viruela vacuna que padecía una mujer contagiada por una vaca enferma. A las pocas semanas inyectó al mismo niño pus procedente de una pústula de un paciente de viruela humana comprobando que aquél no contraía la enfermedad. Jenner pronosticó que su método permitiría en el futuro erradicar la viruela, cosa que resultó ser cierta; sin embargo, la escasez de conocimientos acerca de la naturaleza de las enfermedades infecciosas que imperaba en la época de Jenner motivó que sus estudios permaneciesen en el olvido durante casi un siglo. Una vez más fue Louis Pasteur quien sentó las bases de la moderna inmunología cuando observó que la inyección en gallinas de cultivos envejecidos de la bacteria causante del cólera aviar (Pasteurella aviseptica) las protegía de contraer la enfermedad. Pasteur introdujo el término vacuna, en honor al estudio pionero de Jenner, para referirse a tales preparados a base de un germen atenuado que prevenían de la enfermedad causada por dicho germen. Los estudios de Pasteur fueron el punto de partida para las vacunaciones generalizadas frente a las principales enfermedades infecciosas.
Las investigaciones realizadas a lo largo de todo el siglo XX acerca de los mecanismos responsables de la respuesta inmunitaria convirtieron a la inmunología en una ciencia de importancia extraordinaria para nuestra comprensión de los sistemas vivos y de gran utilidad práctica en la lucha contra las enfermedades infecciosas.
2.- ESTRUCTURA DEL SISTEMA INMUNITARIO.
El sistema inmunitario, entendido en un sentido amplio, integra todo un conjunto de mecanismos defensivos que lo animales han desarrollado para detectar y neutralizar a cualquier agente ajeno al organismo y potencialmente peligroso para él, trátese de microorganismos o de cualquier partícula o sustancia química que pueda ser reconocida como extraña. Este sistema está estructurado en una serie de barreras sucesivas o “líneas defensivas” que se oponen a la entrada del agente. Las primeras líneas defensivas las constituyen diferentes mecanismos que actúan de manera inespecífica contra cualquier agente ajeno al organismo. Todos los animales han desarrollado este tipo de mecanismos de defensa inespecíficos. Además, los vertebrados han desarrollado una serie de mecanismos con capacidad de reconocer de manera específica a los agentes invasores y de guardar memoria de ellos para afrontarlos más eficazmente en posteriores ocasiones. Tales mecanismos de defensa específicos constituyen lo que se conoce como el sistema inmunitario propiamente dicho y representan el principal foco de atención de la inmunología. Analizaremos a continuación los diferentes tipos de mecanismos defensivos.
3.- MECANISMOS DE DEFENSA INESPECÍFICOS.
Los mecanismos de defensa inespecíficos están organizados formando las primeras líneas defensivas y consisten en una serie de barreras anatómicas y físico-químicas, en la protección otorgada por la flora microbiana habitual del organismo y por la acción de las células fagocitarias.
3.1.- BARRERAS ANATÓMICAS Y FÍSICO-QUÍMICAS.
 La primera barrera que han de sobrepasar los microorganismos
infecciosos es la que constituyen la piel y las mucosas. Las capas más
externas de la piel están constituidas por células muertas e
impermeabilizadas por la queratina que representan una barrera
prácticamente infranqueable para la mayoría de los microorganismos. Sólo
algunos patógenos que utilizan insectos picadores como vectores de
transmisión pueden salvar esta barrera. Las secreciones de las glándulas
sudoríparas y sebáceas contribuyen a crear sobre la piel un ambiente
químico hostil para la mayoría de los microorganismos (Figura
21.2).
La primera barrera que han de sobrepasar los microorganismos
infecciosos es la que constituyen la piel y las mucosas. Las capas más
externas de la piel están constituidas por células muertas e
impermeabilizadas por la queratina que representan una barrera
prácticamente infranqueable para la mayoría de los microorganismos. Sólo
algunos patógenos que utilizan insectos picadores como vectores de
transmisión pueden salvar esta barrera. Las secreciones de las glándulas
sudoríparas y sebáceas contribuyen a crear sobre la piel un ambiente
químico hostil para la mayoría de los microorganismos (Figura
21.2).
Algunos órganos externos como los ojos o las cavidades internas comunicadas con el exterior están recubiertos por epitelios denominados mucosas. Las mucosas son más fácilmente franqueables que la piel para la mayoría de los microorganismos; de hecho es a través de ellas por donde se inician la mayoría de las infecciones. No obstante, estos epitelios cuentan también con recursos para combatir a los gérmenes, como la secreción de fluidos que se renuevan constantemente y ayudan así a su eliminación. Además las secreciones de las mucosas suelen presentar propiedades químicas incompatibles con la proliferación de los microorganismos, como el pH ácido del jugo gástrico o de las secreciones vaginales, o bien agentes químicos antibacterianos como en enzima lisozima presente entre otras en la secreción lacrimal.
Por otra parte, la temperatura corporal también constituye una barrera frente a los microorganismos, pues muchos de ellos no pueden vivir a determinadas temperaturas. La fiebre es también un mecanismo defensivo que utiliza este factor.
3.2.- ACCIÓN DE LA FLORA BACTERIANA INTERNA.
En las distintas cavidades internas del organismo animal vive una flora bacteriana adaptada a vivir allí y que ha desarrollado relaciones de comensalismo e incluso simbiosis con el organismo hospedador. Así ocurre en la boca, en el intestino, tracto genital, etc. Estos microorganismos adaptados a las condiciones físico-químicas de su hábitat compiten eficazmente con los posibles invasores e incluso segregan sustancias antibióticas para combatirlos.
3.3.- ACCIÓN DE LAS CÉLULAS FAGOCITARIAS.
Cuando un microorganismo o cualquier otro agente ajeno al organismo hospedador llega a sobrepasar las líneas defensivas que representan las barreras anatómicas y físico-químicas y la flora bacteriana habitual, y accede a los tejidos internos, se desencadena otro mecanismo de defensa inespecífico basado en la acción de células fagocitarias presentes en la sangre. Dos tipos de leucocitos especializados desempeñan esta función: los neutrófilos polimorfonucleares, también llamados micrófagos, y los macrófagos, que se diferencia a partir de los monocitos.
Los micrófagos son los más abundantes y acuden a los tejidos infectados para fagocitar a los agentes invasores atravesando la pared de los capilares sanguíneos. Los macrófagos constituyen una reserva de células fagocitarias presente en los tejidos denominada sistema retículo-endotelial, que además de fagocitar gérmenes participa también en la eliminación de células viejas o deterioradas y en la regeneración de tejidos dañados.
El destino de los microorganismos o partículas fagocitados es su destrucción por los enzimas hidrolíticos presentes en los lisosomas de las células fagocitarias en un proceso típico de digestión heterofágica. En el caso de los micrófagos el proceso termina con la lisis celular, resultado de la liberación de los enzimas lisosómicos, que afecta tanto a los microorganismos fagocitados como al propio micrófago. El conjunto de gérmenes y micrófagos destruidos constituye el pus característico de los tejidos infectados.
Además de micrófagos y macrófagos existe un tercer tipo de leucocitos implicados en este mecanismo de defensa inespecífico. Son las células asesinas naturales (células NK). Se trata de unos linfocitos, diferentes de los implicados en los mecanismos de defensa específicos, que reconocen y destruyen células del propio organismo hospedador que se encuentran infectadas por virus o que se han malignizado (células cancerosas). Las células NK no son fagocitarias, sino que eliminan a las células sobre las que actúan inyectándoles sustancias citotóxicas que provocan su destrucción.
La eficacia de los mecanismos de defensa inespecífica basados en la fagocitosis se ve aumentada por una serie de factores humorales, es decir, no celulares. Los factores humorales son una serie de proteínas solubles que se encuentran en la sangre entre las que destaca el denominado sistema del complemento. El sistema del complemento está constituido por unas veinte proteínas solubles que actúan unas sobre otras produciendo un efecto cascada. Cuando este sistema se activa actúa sobre la superficie de los microorganismos invasores colocando sobre ella moléculas señal que facilitan la acción de las células fagocitarias, en un proceso denominado opsonización. El sistema del complemento forma parte también de los mecanismos de defensa específica que analizaremos más adelante en este capítulo.
Por otra parte, toda la acción de las células fagocitarias se inscribe en un mecanismo de mayor amplitud, denominado respuesta inflamatoria, que facilita la llegada a los tejidos infectados de los recursos celulares y humorales adecuados. La respuesta inflamatoria consiste en una vasodilatación y aumento de la permeabilidad capilar que provoca un edema local, acompañado de fiebre y dolor, en la zona infectada. El líquido extravasado que inunda los tejidos es rico en células fagocitarias y factores humorales necesarios para combatir la infección.
4.- MECANISMOS DE DEFENSA ESPECÍFICOS.
Los vertebrados, y muy especialmente los mamíferos, han desarrollado a lo largo de la evolución biológica una línea defensiva adicional frente a los agentes invasores basada en la capacidad de distinguir “lo propio” de “lo ajeno”. Esta línea defensiva comprende un conjunto de mecanismos de defensa específicos que integran el sistema inmunitario propiamente dicho. Los procesos que se desencadenan cuando un agente invasor es detectado por el sistema inmunitario se conocen con el nombre de respuesta inmunitaria. La respuesta inmunitaria exhibe tres propiedades que la caracterizan:
-
Especificidad.- El sistema inmunitario genera una respuesta específica para cada agente invasor. La respuesta generada frente a un determinado agente no es activa frente a otros.
-
Memoria.- La respuesta generada frente a un determinado agente queda registrada por el sistema inmunitario de manera que las respuestas frente a posteriores invasiones del mismo agente son más intensas y eficaces.
-
Tolerancia.- El sistema inmunitario no debe generar respuestas frente a células o moléculas del propio organismo. La tolerancia ante “lo propio” se desarrolla durante las primeras semanas del desarrollo embrionario. El sistema inmunitario es potencialmente capaz de generar respuesta ante cualquier molécula, por lo que durante este período debe “aprender” a reconocer las moléculas del propio organismo y a desarrollar tolerancia ante ellas. Los errores en este mecanismo dan lugar a enfermedades autoinmunes, que suelen tener consecuencias graves.
La acción del sistema inmunitario se basa en su capacidad para reconocer moléculas ajenas al organismo, que pueden encontrarse disueltas en la sangre y líquido intersticial o bien ancladas en la superficie de los microorganismos invasores. El sistema inmunitario no reconoce pues a los microorganismos invasores como tales sino a estructuras moleculares que éstos presentan en la superficie celular. Las moléculas capaces de generar una respuesta inmunitaria se denominan antígenos.
Por supuesto, no todas las moléculas ajenas a un organismo dado tienen capacidad antigénica. Ésta depende de varios factores, algunos intrínsecos a la propia molécula y otros relativos al organismo hospedador. Entre los factores intrínsecos cabe destacar los siguientes:
-
Similitud con moléculas propias.- En general, las moléculas con un gran parecido estructural a moléculas propias del organismo receptor carecen de capacidad antigénica. Así, proteínas cuya secuencia de aminoácidos ha divergido mucho evolutivamente entre especies diferentes suelen generar respuesta inmunitaria, mientras que no lo hacen aquellas cuya secuencia se ha conservado más o menos constante, como es el caso del citocromo C o el colágeno.
-
Tamaño.- Para tener capacidad antigénica las moléculas deben ser relativamente grandes, aunque este factor depende también de la naturaleza química. Las biomoléculas de bajo peso molecular, como aminoácidos y monosacáridos carecen de capacidad antigénica. Aunque no existe una regla fija se puede afirmar que las moléculas de peso molecular inferior a 10.000 dalton no suelen ser buenos antígenos.
-
Naturaleza química.- Los distintos tipos de biomoléculas tienen diferentes capacidades antigénicas. En general, las proteínas son mejores antígenos que los polisacáridos y éstos que los lípidos y ácidos nucleicos.
-
Heterogeneidad química.- Los polímeros monótonos suelen presentar menos capacidad antigénica que los de composición más heterogénea.
-
Degradabilidad.- Sólo las moléculas que son degradables por el metabolismo del organismo receptor tienen capacidad antigénica. Ello se debe a que el mecanismo que desencadena la respuesta inmunitaria requiere la presencia de fragmentos del antígeno.
En cuanto a los factores extrínsecos al antígeno que afectan a su capacidad antigénica hay que destacar la constitución genética del organismo receptor. Unos organismos son genéticamente más sensibles a determinados antígenos de lo que lo son otros.
La capacidad de un antígeno para desencadenar una respuesta inmunitaria no reside en la molécula antigénica en su conjunto, sino en determinados grupos químicos situados sobre su superficie denominados determinantes antigénicos o epitopos. Estos grupos químicos pueden grupos de aminoácidos o motivos estructurales en las proteínas, determinadas ramificaciones en los polisacáridos y otras estructuras de tamaño reducido en comparación con el de la molécula antigénica completa. Los epitopos, además de ser los responsables de la puesta en marcha de la respuesta inmunitaria, son los lugares por los que los antígenos se unen a las moléculas específicas generadas en dicha respuesta.
Existen compuestos de bajo peso molecular, denominados haptenos, que no tienen capacidad antigénica por sí solos, pero que se transforman en determinantes antigénicos cuando se encuentran unidos a una macromolécula. Los haptenos han sido de gran utilidad en la investigación de la respuesta inmunitaria.
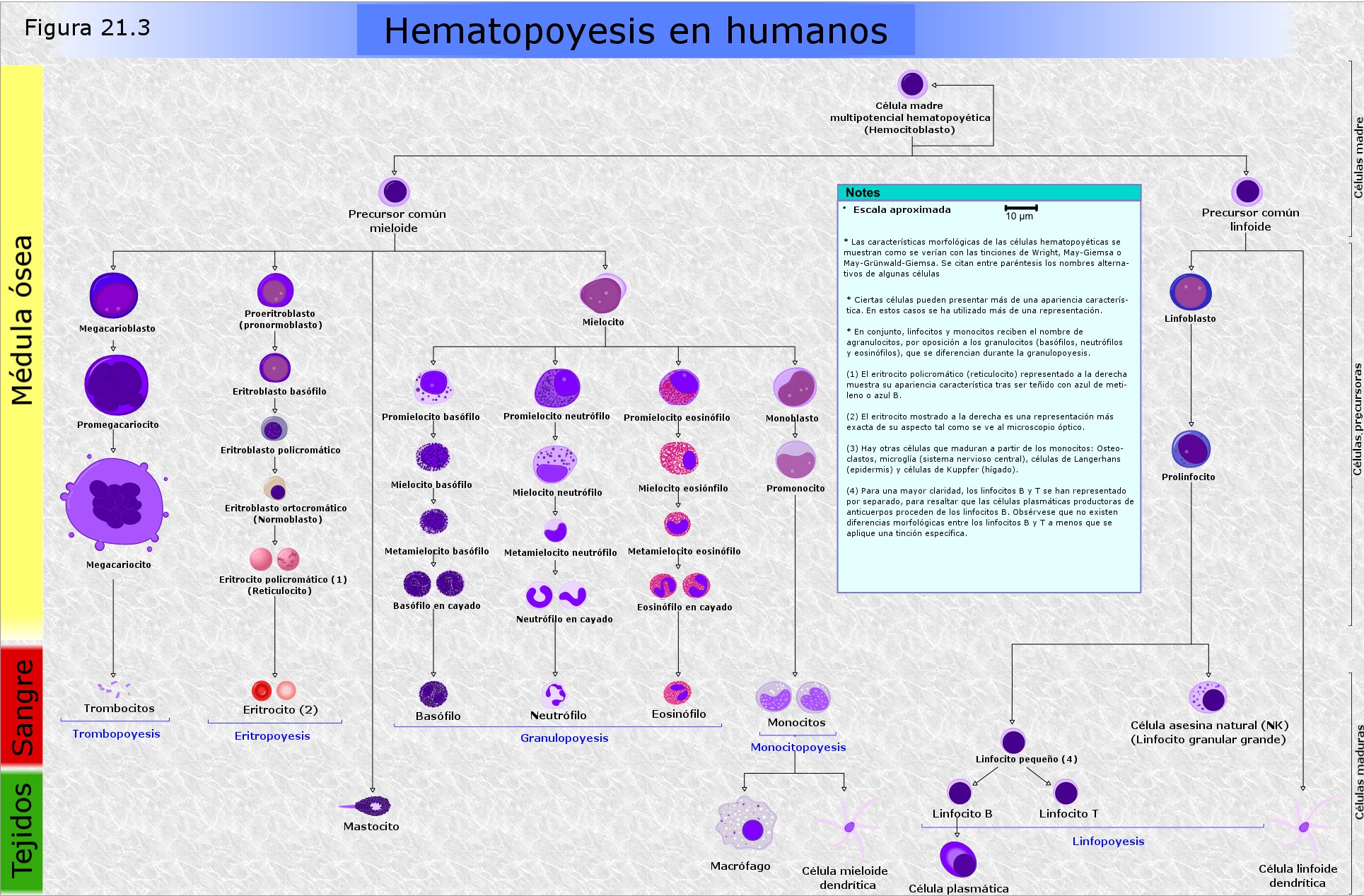
La respuesta inmunitaria se produce por la actividad de una estirpe de células sanguíneas del grupo de los leucocitos, llamadas linfocitos. En el proceso de formación de las células sanguíneas, la hematopoyesis (Figura 21.3: click para ampliar), los linfocitos se originan en el individuo adulto a partir de células madre de la médula ósea y maduran después en distintos órganos linfoides. La respuesta inmunitaria tiene lugar en dos fases sucesivas, denominadas respectivamente respuesta inmunitaria humoral y respuesta inmunitaria celular, que analizaremos a continuación.

4.1.- RESPUESTA INMUNITARIA HUMORAL.
Las células responsables de la respuesta inmunitaria humoral son los linfocitos B, que en los mamíferos maduran en la propia médula ósea (la “B” es la inicial de bone, hueso en inglés). Los linfocitos B tienen la capacidad de sintetizar unas proteínas, denominadas inmunoglobulinas, que constituyen la base de la respuesta inmunitaria. Hay dos tipos principales de inmunoglobulinas: las inmunoglobulinas de membrana (mIg) y las inmunoglobulinas circulantes, también llamadas anticuerpos, que son los auténticos efectores de la respuesta inmunitaria humoral
Formando parte de la membrana de los linfocitos B se encuentran unos complejos receptores de las células B (BCR), cuya parte específica es una inmunoglobulina de membrana. La misión de estos complejos receptores es reconocer a los antígenos como etapa inicial de la respuesta inmunitaria. Existen unos 150.000 moléculas de mIg la membrana de cada linfocito, siendo todas ellas específicas del mismo antígeno. Cuando un antígeno entra en contacto con los complejos receptores se desencadena una reacción intracelular que da lugar a la síntesis de numerosas moléculas de anticuerpos específicos que son secretados al medio extracelular, donde pueden ejercer su acción sobre las moléculas del antígeno.
4.1.1.- ESTRUCTURA DE LAS INMUNOGLOBULINAS.
 El análisis de la secuencia de aminoácidos de las
inmunoglobulinas y de su conformación tridimensional mediante
cristalografía de rayos X, ha proporcionado un amplio conocimiento de
estas proteínas, lo que ha contribuido en gran medida a nuestra
comprensión de los mecanismos de la respuesta inmunitaria.
El análisis de la secuencia de aminoácidos de las
inmunoglobulinas y de su conformación tridimensional mediante
cristalografía de rayos X, ha proporcionado un amplio conocimiento de
estas proteínas, lo que ha contribuido en gran medida a nuestra
comprensión de los mecanismos de la respuesta inmunitaria.
Las inmunoglobulinas son proteínas oligoméricas formadas por cuatro cadenas polipeptídicas (Figura 21.5). De ellas, dos son “cadenas pesadas” (H), con un peso molecular de unos 50.000 daltons, y las otras dos son “cadenas ligeras” (L), con un peso molecular de unos 25.000 daltons. Cada cadena ligera está unida a una cadena pesada por un puente disulfuro, mientras que las dos cadenas pesadas están unidas entre sí por dos puentes disulfuro. El conjunto de las cuatro cadenas se encuentra plegado en una conformación tridimensional característica de las inmunoglobulinas que presenta forma de “Y”. Los brazos cortos de la “Y” están constituidos por la cadenas ligeras y por la porción amino terminal de las cadenas pesadas, se pueden escindir enzimáticamente de la molécula dando lugar a dos fragmentos que, por su capacidad de unirse a antígenos, se denominan fragmentos Fab (del inglés antigen-binding). El brazo largo de la “Y” está constituido por las porciones carboxi-terminales de las cadenas pesadas, también se puede separar enzimáticamente del resto de la molécula y, debido a que cristaliza con facilidad, se denomina fragmento Fc. La zona de unión de los tres fragmentos se conoce como región bisagra
 Tanto en las cadenas pesadas como en las ligeras se
distinguen dos regiones. Una de ellas, llamada región constante, se
encuentra en la zona del extremo carboxi-terminal y presenta pocas
variaciones en la secuencia de aminoácidos entre unas inmunoglobulinas y
otras, mientras que en relación con la otra, próxima al extremo
amino-terminal y denominada región variable, existen inmunoglobulinas
con multitud de secuencias diferentes. Las regiones constantes de las
cadenas pesadas presentan en humanos cinco tipos principales de
secuencias que determinan los cinco tipos principales de
inmunoglobulinas (isotipos) que se especificarán más adelante. Las
regiones constantes de las cadenas ligeras aparecen en dos versiones
diferentes con ligeras variaciones entre una y la otra; son las cadenas
κ y las cadenas λ. Cada tipo de cadena pesada puede combinarse
indistintamente con las cadenas ligeras κ o λ, pero en cada molécula
individual de inmunoglobulina tanto las cadenas pesadas como las ligeras
corresponden al mismo tipo. La formación de puentes disulfuro
adicionales entre las regiones constantes de las cadenas pesadas puede
dar lugar a asociaciones multiméricas de varias moléculas individuales
de inmunoglobulina.
Tanto en las cadenas pesadas como en las ligeras se
distinguen dos regiones. Una de ellas, llamada región constante, se
encuentra en la zona del extremo carboxi-terminal y presenta pocas
variaciones en la secuencia de aminoácidos entre unas inmunoglobulinas y
otras, mientras que en relación con la otra, próxima al extremo
amino-terminal y denominada región variable, existen inmunoglobulinas
con multitud de secuencias diferentes. Las regiones constantes de las
cadenas pesadas presentan en humanos cinco tipos principales de
secuencias que determinan los cinco tipos principales de
inmunoglobulinas (isotipos) que se especificarán más adelante. Las
regiones constantes de las cadenas ligeras aparecen en dos versiones
diferentes con ligeras variaciones entre una y la otra; son las cadenas
κ y las cadenas λ. Cada tipo de cadena pesada puede combinarse
indistintamente con las cadenas ligeras κ o λ, pero en cada molécula
individual de inmunoglobulina tanto las cadenas pesadas como las ligeras
corresponden al mismo tipo. La formación de puentes disulfuro
adicionales entre las regiones constantes de las cadenas pesadas puede
dar lugar a asociaciones multiméricas de varias moléculas individuales
de inmunoglobulina.
Dentro de las regiones variables, la variabilidad en la secuencia de aminoácidos se concentra en determinados tramos denominados regiones hipervariables. La presencia de estas regiones, junto con el hecho de que se encuentran en los extremos de dos cadenas diferentes (H y L) que pueden adoptar distintas posiciones una con respecto a la otra, da lugar a una gran variedad de posibilidades en lo que se refiere a la conformación tridimensional de estas regiones. Se ha podido comprobar que estos extremos variables de las inmunoglobulinas son los lugares a través de los cuales éstas interactúan con las moléculas de antígeno. La gran diversidad estructural de los extremos variables permite a las inmunoglobulinas reconocer e interactuar con una cantidad enorme de antígenos diferentes.
En la especie humana las inmunoglobulinas circulantes (anticuerpos) aparecen en cinco clases principales o isotipos (Figura 21.7), que difieren en la secuencia de aminoácidos de la región constante de sus cadenas pesadas. Son las siguientes:
-
Inmunoglobulina G (IgG).- Son con mucho las más abundantes en la sangre y líquidos intersticiales, llegando a representar un 80% de las inmunoglobulinas totales. Son las más persistentes y responsables de la memoria inmunitaria.
-
Inmunoglobulina A (IgA).- Representan un 5-10% de las inmunoglobulinas totales. Puede aparecer como moléculas individuales o formando dímeros unidos por puentes disulfuro. Este tipo de inmunoglobulina aparece fundamentalmente en las secreciones de todo tipo (saliva, lágrimas, mucus respiratorio) por lo que desempeñan un papel esencial en la defensa de los epitelios mucosos. También están presentes en la leche materna y en el calostro, contribuyendo así a la protección del lactante frente a las infecciones.
-
Inmunoglobulina M (IgM).- Representan un 10-15% de las inmunoglobulinas totales. Se sintetizan en forma de pentámeros de forma estrellada con las regiones variables hacia el exterior. Debido a su gran tamaño no se extravasan y permanecen confinadas en el suero sanguíneo. Son las primeras en aparecer ante la presencia de un antígeno.
-
Inmunoglobulina D (IgD).- Aparece como un componente de la membrana de los linfocitos junto con la inmunoglobulina de membrana mIg. Su presencia en el suero sanguíneo es insignificante.
-
Inmunoglobulina E (IgE).- Se encuentran en el suero sanguíneo en cantidades muy pequeñas. Son las responsables de los fenómenos de hipersensibilidad (alergias). Su papel reside en su eficacia frente a patógenos grandes como los helmintos (Tenia, Trichinella y otros).

4.1.2.- REACCIÓN ANTÍGENO-ANTICUERPO.
 La interacción antígeno-anticuerpo es un caso particular de
la interacción que se produce entre un ligando específico y su proteína
correspondiente, es decir, se trata de una interacción no covalente,
reversible y basada en interacciones débiles del tipo de los puentes de
hidrógeno, interacciones iónicas o hidrofóbicas y fuerzas de Van der
Waals. La especificidad de la interacción se debe a la complementariedad
estructural entre los epitopos del antígeno y las regiones variables del
anticuerpo.
La interacción antígeno-anticuerpo es un caso particular de
la interacción que se produce entre un ligando específico y su proteína
correspondiente, es decir, se trata de una interacción no covalente,
reversible y basada en interacciones débiles del tipo de los puentes de
hidrógeno, interacciones iónicas o hidrofóbicas y fuerzas de Van der
Waals. La especificidad de la interacción se debe a la complementariedad
estructural entre los epitopos del antígeno y las regiones variables del
anticuerpo.
Las interacciones entre antígenos y anticuerpos dan lugar a complejos estables antígeno-anticuerpo. Cada molécula individual de inmunoglobulina tiene dos lugares de unión al antígeno. Cuando estas moléculas forman dímeros o multímeros como en la IgA e IgM el número de lugares de unión por complejo aumenta. Por otra parte, cada antígeno puede presentar varios epitopos mediante los que interactuar con el anticuerpo. El resultado es que, en el caso de los antígenos solubles, los complejos antígeno-anticuerpo pueden formar redes tridimensionales que incluyen muchas moléculas de uno y otro tipo (Figura 21.8). Cuando los antígenos se encuentran anclados en la superficie de microorganismos invasores los complejos antígeno-anticuerpos son más simples y de menor tamaño.
En el caso de los antígenos solubles, como es el caso de las toxinas secretadas por algunos microorganismos o, en general, de cualquier macromolécula soluble ajena al organismo receptor, la formación del complejo antígeno-anticuerpo tiene las siguientes consecuencias:
-
Neutralización.- La unión con el anticuerpo inhabilita al antígeno para ejercer el efecto tóxico que pudiera tener. Algunas toxinas bacterianas no pueden unirse a sus receptores en la superficie celular cuando están unidas a su anticuerpo específico. Muchos virus, aunque son complejos supramoleculares también pueden resultar neutralizados el mismo modo por anticuerpos específicos
-
Precipitación.- La formación de grandes entramados antígeno-anticuerpo impide a ambos tipos de moléculas permanecer en disolución, dando lugar a un precipitado.
En cualquier caso el destino final de los complejos antígeno-anticuerpo es ser fagocitados y digeridos por las células fagocitarias (micrófagos y macrófagos). Así, el mecanismo de defensa específico de la respuesta inmunizante humoral, interactúa con el mecanismo de defensa inespecífico de las células fagocitarias, que complementa la acción del primero. La porción carboxi-terminal de las cadenas pesadas de las inmunoglobulinas (fragmento Fc), que no está implicada en la formación de los complejos antígeno-anticuerpo, es reconocida por receptores de membrana de las células fagocitarias. Ello permite a estas células fagocitar los complejos antígeno-anticuerpo mediante endocitosis mediada por receptores específicos que es mucho más eficaz que la endocitosis convencional.
Cuando los antígenos se encuentran anclados a la superficie de microorganismos invasores la formación de complejos antígeno-anticuerpo sobre dicha superficie tiene las siguientes consecuencias:
-
Activación del sistema del complemento.- El conjunto de proteínas que integra el sistema del complemento, que también participa en los mecanismos de defensa inespecíficos, provoca lisis celular de los microorganismos invasores reconocidos por los anticuerpos.
-
Opsonización.- El microorganismo cuyos antígenos de superficie han sido reconocidos por los anticuerpos queda literalmente erizado de fragmentos Fc de las inmunoglobulinas Estos fragmentos, como hemos comentado con anterioridad, constituyen señales que las células fagocitarias reconocen y utilizan para mejorar su eficacia. También en este caso los mecanismos específicos e inespecíficos cooperan en la defensa del organismo.
4.1.3.- ORIGEN DE LA DIVERSIDAD DE LOS ANTICUERPOS.
Uno de los aspectos más intrigantes del fenómeno de la respuesta inmunitaria fue durante mucho tiempo el origen de la gran diversidad de anticuerpos necesaria para poder reconocer a un número potencialmente infinito de antígenos. Puesto que los anticuerpos son proteínas, la explicación más acorde con la ortodoxia de la teoría “un gen – un polipéptido” apuntaba a que debía existir un número elevadísimo de genes codificadores de inmunoglobulinas, tanto para las cadenas pesadas como para las ligeras. De acuerdo con esta explicación, conocida a mediados del siglo XX como teoría germinal, una parte muy significativa del genoma estaría dedicada a la codificación de las inmunoglobulinas (los cálculos apuntaban a una cifra en torno a los 100.000 genes en la especie humana, cuando hoy sabemos que el total de genes no supera los 30.000). Una explicación alternativa, conocida como teoría de la variación somática apuntaba a un número de genes mucho menor, que mediante mecanismos de mutación y/o recombinación generaría durante la maduración de los linfocitos el amplio repertorio de anticuerpos requerido. Un inconveniente de esta teoría consistía en que no explicaba satisfactoriamente la presencia de regiones variables y regiones constantes en las inmunoglobulinas.
En 1965 W.J. Dreyer y J.C. Bennett propusieron un modelo para explicar la diversidad de los anticuerpos según el cual las regiones variables y las regiones constantes, tanto de las cadenas pesadas como de las ligeras, estaban codificadas por genes diferentes. Estos genes se encontrarían separados en las células de la línea germinal, pero durante la maduración de los linfocitos B el genoma sufriría distintas reordenaciones que colocarían adyacentes los fragmentos codificantes para uno y otro tipo de región, dando lugar a un mensaje continuo que codificaría una cadena completa. Además, existiría, de acuerdo con la teoría germinal, un elevado número de genes
 Las ideas de Dreyer y Bennett fueron consideradas
“heréticas” en su momento pues contradecían algunos dogmas de la
naciente biología molecular. Sin embargo, cuando diez años más tarde
Susumu Tonegawa (Figura
21.9) dispuso de las herramientas adecuadas para someterlas a la
experimentación, se comprobó que no sólo apuntaban en la dirección
correcta, sino que sus autores se habían quedado cortos en su
apreciación de un mecanismo que resultó ser mucho más complejo y
sofisticado.
Las ideas de Dreyer y Bennett fueron consideradas
“heréticas” en su momento pues contradecían algunos dogmas de la
naciente biología molecular. Sin embargo, cuando diez años más tarde
Susumu Tonegawa (Figura
21.9) dispuso de las herramientas adecuadas para someterlas a la
experimentación, se comprobó que no sólo apuntaban en la dirección
correcta, sino que sus autores se habían quedado cortos en su
apreciación de un mecanismo que resultó ser mucho más complejo y
sofisticado.
Tonegawa demostró que la información genética que codifica la secuencia de aminoácidos de las inmunoglobulinas se encuentra en las células germinales fragmentada en una serie de segmentos génicos. Estos segmentos constituyen familias multigénicas encargadas de codificar los distintos tipos de cadenas (Figura 21.10). Hay tres familias principales, que se encuentran situadas en diferentes cromosomas: una que codifica las cadenas ligeras κ, otra las cadenas ligeras λ y una tercera las cadenas pesadas. Cada familia se compone de varios tipos de segmentos (V, D, J, C y L), cada uno de los cuales puede aparecer en diferentes versiones o subtipos (p. ej. V1, V2, V3, etc.). Los segmentos de las familias V, D y J codifican las regiones variables; los segmentos C codifican las regiones constantes y los segmentos L codifican un péptido señal presente en las cadenas recién sintetizadas que se elimina posteriormente.
 Durante el proceso de maduración de los linfocitos B los
segmentos codificantes sufren reordenaciones, diferentes en cada línea
individual, de manera que la secuencia de DNA que finalmente codificará
una cadena de una inmunoglobulina se ensambla tomando segmentos de las
distintas familias siguiendo una pauta característica de cada tipo de
cadena (H o L). Así, las cadenas ligeras muestran una secuencia de
segmentos Vi+Ji+Ci, mientras que las
pesadas muestran una secuencia Vi+Ji+Di+Ci,
donde
el subíndice indica la variante incluida en cada tipo de segmento. De
este modo, con un número discreto de segmentos diferentes (en realidad
unos pocos centenares) se puede formar un número elevado de
combinaciones que presentarían especificidades para antígenos
diferentes. Los segmentos del tipo C presentan pocas variantes y no
afectan a la especificidad del anticuerpo, sino que son las que
determinan el isotipo al que pertenece.
Durante el proceso de maduración de los linfocitos B los
segmentos codificantes sufren reordenaciones, diferentes en cada línea
individual, de manera que la secuencia de DNA que finalmente codificará
una cadena de una inmunoglobulina se ensambla tomando segmentos de las
distintas familias siguiendo una pauta característica de cada tipo de
cadena (H o L). Así, las cadenas ligeras muestran una secuencia de
segmentos Vi+Ji+Ci, mientras que las
pesadas muestran una secuencia Vi+Ji+Di+Ci,
donde
el subíndice indica la variante incluida en cada tipo de segmento. De
este modo, con un número discreto de segmentos diferentes (en realidad
unos pocos centenares) se puede formar un número elevado de
combinaciones que presentarían especificidades para antígenos
diferentes. Los segmentos del tipo C presentan pocas variantes y no
afectan a la especificidad del anticuerpo, sino que son las que
determinan el isotipo al que pertenece.
Las reordenaciones se llevan a cabo por la acción de un equipo de enzimas específicos que cortan y empalman los segmentos de DNA. Los lugares de corte están señalizados por unas secuencias específicas denominadas secuencias señalizadoras de recombinación (RSS).
Adicionalmente, se ha detectado en linfocitos B con las secuencias codificantes para inmunoglobulinas ya reordenadas un fenómeno conocido como hipermutación somática, que ocurre tras el primer contacto del antígeno con los receptores de membrana del linfocito. El fenómeno consiste en un aumento espectacular de la tasa de mutación en las secuencias que codifican las regiones variables de las inmunoglobulinas. Las mutaciones introducen ligeras variaciones en la conformación de las regiones variables que repercuten en su afinidad por el antígeno. Posteriormente se seleccionan para generar la respuesta inmunitaria aquellas líneas de linfocitos B portadoras de las mutaciones que confieren una mayor afinidad.
4.2.- RESPUESTA INMUNITARIA CELULAR.
La respuesta inmunitaria humoral por sí sola constituye una poderosa barrera defensiva contra los microorganismos patógenos siempre que éstos se encuentren libres en el medio interno del organismo receptor. Sin embargo se muestra poco eficaz frente a parásitos intracelulares como los virus y algunas bacterias y protozoos, a las que los anticuerpos circulantes no tienen acceso, al menos durante alguna fase de su ciclo vital. Para solventar ese problema algunos vertebrados se han dotado de un sistema que funciona en paralelo con la inmunidad humoral, con la que además interactúa. Es la respuesta inmunitaria celular.
La respuesta inmunitaria celular es un complejo mecanismo diseñado para localizar y destruir células del propio organismo receptor que hayan sido invadidas por parásitos intracelulares. También puede actuar sobre células cancerosas y sobre tejidos ajenos al organismo receptor como ocurre en el caso de los transplantes de órganos.
Las células responsables de la respuesta inmunitaria celular son un tipo de leucocitos que tienen su origen en la médula ósea pero que maduran en un órgano linfoide llamado timo. En referencia a este órgano se denominan linfocitos T. En el ser humano el timo entra en regresión a partir de la adolescencia y desde entonces los linfocitos T maduran en otros órganos linfoides diseminados. La respuesta generada por los linfocitos T consiste en la liberación de una serie de sustancias citotóxicas, que destruyen células infectadas, o de mensajeros intercelulares, llamados citoquinas, que inducen la proliferación y estimulan la actividad e otras células del sistema inmunitario.
 Los linfocitos T presentan en la cara externa de sus
membranas unos complejos receptores de las células T (TCR)
análogos a los correspondientes de los linfocitos B (Figura
21.11). El componente principal de los TCR es una proteína de
estructura similar a la de las inmunoglobulinas, formada por dos cadenas
polipeptídicas cada una de las cuales tiene una región constante y una
región variable. Esta proteína del TCR, al igual que las
inmunoglobulinas de membrana de los linfocitos B, es la responsable de
reconocer al antígeno en la etapa inicial de la respuesta inmunitaria
celular.
Los linfocitos T presentan en la cara externa de sus
membranas unos complejos receptores de las células T (TCR)
análogos a los correspondientes de los linfocitos B (Figura
21.11). El componente principal de los TCR es una proteína de
estructura similar a la de las inmunoglobulinas, formada por dos cadenas
polipeptídicas cada una de las cuales tiene una región constante y una
región variable. Esta proteína del TCR, al igual que las
inmunoglobulinas de membrana de los linfocitos B, es la responsable de
reconocer al antígeno en la etapa inicial de la respuesta inmunitaria
celular.
El proceso de reconocimiento del antígeno es en la respuesta inmunitaria celular mucho más complejo que en la humoral. En él interviene un conjunto de proteínas del organismo receptor y los genes que las codifican que se conocen con el nombre global de complejo principal de histocompatibilidad (MHC). Las proteínas MHC forman parte de la membrana celular y su misión es exponer fragmentos de antígenos sobre la superficie de la célula, de manera que éstos puedan ser reconocidos por los TCR de los linfocitos T (Figura 21.11). Los TCR, a diferencia de los BCR, no pueden reconocer antígenos libres, sino fragmentos de éstos (péptidos cortos) que se encuentran unidos a proteínas MHC (hecho que se conoce como restricción por el MHC).
Hay dos tipos de proteínas MHC:
-
Proteínas MHC de clase I.- Se encuentran en todas las células nucleadas del organismo receptor. Reconocen y exponen sobre la superficie celular fragmentos antigénicos de origen endógeno, es decir sintetizados dentro de las propias células. Estos fragmentos pueden ser de proteínas víricas, si la célula se encuentra infectada por un virus, o proteínas tumorales de una célula cancerosa.
-
Proteínas MHC de clase II.- Se encuentran exclusivamente en las llamadas células presentadoras de antígeno (APC) del sistema inmunitario. Las principales células presentadoras de antígeno son los macrófagos, que fagocitan de manera inespecífica microorganismos invasores, y los propios linfocitos B, que también pueden fagocitar los antígenos que desencadenan en ellos la respuesta humoral.
Existen dos tipos principales de linfocitos T, responsables de sendas modalidades de respuesta inmunitaria celular (Figura 21.10):
-
Linfocitos T citotóxicos.- Reconocen mediante sus TCR fragmentos antigénicos presentados por proteínas MHC de clase I ancladas en la superficie de células infectadas por virus o que se han malignizado. El reconocimiento del antígeno desencadena en el linfocito T un doble respuesta: por una parte, el linfocito secreta unas citoquinas, denominadas interleucinas, que inducen la proliferación de linfocitos T con la misma especificidad antigénica; por otra, el linfocito mata a la célula infectada inyectándole enzimas citotóxicas como las fragmentinas, que desencadenan en la célula infectada los mecanismos de muerte celular programada (apoptosis), y las perforinas, que abren poros en la membrana plasmática induciendo la lisis celular por fenómenos osmóticos.
-
Linfocitos T auxiliares.- Reconocen mediante sus TCR fragmentos antigénicos presentados por proteínas MHC de clase II ancladas en la superficie de células presentadoras de antígenos. La interacción entre ambos tipos celulares desencadena en los linfocitos T auxiliares una respuesta consistente en la liberación de distintos tipos de citoquinas, que estimulan la proliferación de los propios linfocitos así como la actividad de las células presentadoras. En unos casos los fragmentos antigénicos son presentados por un macrófago y proceden de la digestión parcial de microorganismos invasores fagocitados por éste. La respuesta generada estimula por una parte la proliferación del clon de linfocitos T auxiliares implicado, y por otra aumenta la capacidad de los macrófagos para destruir por completo al germen estimulando la producción de lisosomas. En otros casos los fragmentos antigénicos son presentados por un linfocito B y proceden de la digestión de antígenos libres que ya han generado una respuesta de tipo humoral. La respuesta en esta ocasión consiste en la liberación de interleucinas por el linfocito T auxiliar, que inducen la proliferación del clon de linfocitos B específico del antígeno, aumentando así la producción de anticuerpos circulantes.
5.- INTEGRACIÓN DE LOS MECANISMOS DE DEFENSA.
La discusión precedente demuestra que los distintos tipos mecanismos defensivos que han desarrollado los animales frente a los agentes infecciosos no funcionan aislada e independientemente unos de otros, sino más bien como partes complementarias e interactuantes de un todo integrado. Es posible que las distinciones entre mecanismos específicos e inespecíficos, o entre inmunidad humoral e inmunidad celular, sean más artefactos académicos que otra cosa y que, aunque se les pueda reconocer un cierto valor a la hora de sistematizar el conocimiento inmunológico, no estén reflejando adecuadamente una realidad mucho más compleja de lo que esas distinciones dibujan.
6.- MEMORIA INMUNITARIA.
Una de las propiedades más relevantes del sistema inmunitario es su capacidad para registrar los antígenos que han desencadenado una respuesta por su parte de tal modo que si posteriormente se produce un nuevo contacto con uno de ellos la respuesta generada es de mayor amplitud y eficacia. El mecanismo que explica esta propiedad se inscribe en el marco de la teoría de la selección clonal, que analizaremos a continuación.
Los linfocitos son uno de los tipos celulares más abundantes en el organismo. Se calcula que en un ser humano adulto hay alrededor de un billón de linfocitos, lo que representa aproximadamente un 2% del peso corporal. En tal población de linfocitos, que se renueva a un ritmo de mil millones por día, hay células con receptores específicos para prácticamente cualquier antígeno posible. Cuando tiene lugar el primer contacto con el antígeno se desencadena una una respuesta primaria humoral y/o celular. Aquellos linfocitos B con receptores BCR capaces de reconocer el antígeno, con la ayuda de los linfocitos T auxiliares, se dividen intensamente y proliferan para dar lugar a un numeroso clon de células competentes para combatirlo. Lo mismo ocurre en su caso con los linfocitos T específicos del antígeno. En el clon seleccionado de linfocitos B pronto se diferencian dos líneas celulares: una de ellas, las denominadas células plasmáticas, se encarga de producir anticuerpos, inicialmente del isotipo IgM y a continuación del IgG. Tanto los anticuerpos circulantes como las células plasmáticas que los producen tienden a desaparecer gradualmente una vez neutralizado el antígeno, con lo que finaliza la respuesta primaria.
La otra línea celular la integran las denominadas células de memoria, que persisten durante largos períodos “acuarteladas” en los órganos linfáticos en prevención de un eventual nuevo contacto con el antígeno. Si ese contacto se produce, sobreviene la respuesta secundaria. Las células de memoria proliferan rápidamente dando lugar a un nuevo clon de células plasmáticas, mucho más numeroso que el generado en la respuesta primaria, que produce y libera una gran cantidad de anticuerpos del isotipo IgG. Todo ello ocurre en paralelo con un nuevo proceso de selección clonal similar al ocurrido durante la respuesta primaria.
En la respuesta secundaria se consigue una concentración de anticuerpos en los tejidos afectados mucho mayor que en la respuesta primaria, y además se consigue mucho más rápidamente, todo lo cual repercute positivamente en la eficacia de la respuesta (Figura 21.11).
6.- INMUNIDAD NATURAL.
Además de utilizarse en sentido amplio para referirse al conjunto de mecanismos defensivos analizados en el presente capítulo, el término inmunidad se viene utilizando ya desde la antigüedad para aludir a un estado de resistencia que presenta un organismo frente a la infección. A la luz de los conocimientos actuales se dice que un organismo es inmune frente a un determinado germen cuando su sistema inmunitario es capaz de desactivarlo sin que llegue a aparecer una reacción patológica. La inmunidad frente a un determinado microorganismo patógeno puede ser congénita o adquirida.
-
Inmunidad congénita.- La confieren los mecanismos de defensa inespecíficos de las primeras líneas defensivas sin que medie contacto previo con el patógeno. Suele ser debida a características fisiológicas de la especie que la hacen incompatible con el microorganismo invasor. Así, por ejemplo, los pollos son inmunes frente al Bacillus antracis, agente causante del ántrax en distintas especies animales, debido a que su temperatura corporal es demasiado elevada para el crecimiento de este germen. También puede suceder que dentro de la misma especie determinados individuos presenten inmunidad congénita frente a una enfermedad debido a causas genéticas. Por ejemplo, se ha podido comprobar que aproximadamente un 1% de la humanidad presenta inmunidad congénita frente al VIH, el agente causante del SIDA, debido a causas genéticas todavía no aclaradas.
-
Inmunidad adquirida.- La confieren los mecanismos de defensa específicos y está relacionada con el fenómeno de la memoria inmunitaria, anteriormente descrito. Es conocido ya desde la antigüedad que determinados gérmenes inducen en los individuos infectados resistencia frente a nuevas infecciones durante largos períodos. La explicación de este fenómeno estaría en las características de las respuestas inmunitarias primaria y secundaria y en la persistencia en los órganos linfáticos de células de memoria específicas del germen. El tipo de inmunidad descrito se adquiere de forma activa, pues es el propio organismo hospedador el que genera la respuesta inmunitaria frente al germen. La inmunidad natural también se puede adquirir de forma pasiva, mediante anticuerpos fabricados por otro organismo, como en el caso de los transmitidos de madre a hijo a través de la placenta o de la leche materna. La inmunidad natural pasiva, al depender de la persistencia de los anticuerpos suministrados y no de células de memoria, es siempre mucho menos duradera que la activa.
7.- INMUNIDAD ARTIFICIAL: SUEROS Y VACUNAS.
Desde los primeros tiempos de la ciencia inmunológica, los investigadores trataron de encontrar la manera de inducir artificialmente en seres humanos el estado de resistencia frente a la enfermedad que hemos descrito con el nombre de inmunidad. Se puede afirmar que los intentos de combatir la enfermedad por medio de la inmunidad artificial han constituido el auténtico hilo conductor de la inmunología durante los últimos 200 años. Los éxitos obtenidos en esta lucha representan una de las mayores contribuciones de la ciencia al bienestar de la humanidad.
Podemos distinguir entre dos formas de inmunidad artificial:
-
INMUNIDAD ARTIFICIAL PASIVA.- Se induce mediante la inyección de sueros. Un suero es un preparado artificial que contiene anticuerpos contra el germen que se desea combatir. Estos anticuerpos han sido sintetizados por un organismo diferente del receptor previamente inoculado con dicho germen. Antiguamente se utilizaban animales para la obtención de sueros, pero en la actualidad se obtienen a partir de cultivos de células humanas, que producen inmunoglobulinas mucho más parecidas a las del organismo receptor.
-
INMUNIDAD ARTIFICIAL ACTIVA.- Se induce mediante la inyección de vacunas. Una vacuna es un preparado artificial que contiene antígenos característicos del germen que se desea combatir. La vacuna induce en el organismo receptor una respuesta inmunitaria primaria con producción de células de memoria. Si tras la vacunación se produce una infección natural por el mismo germen, se desencadena directamente una respuesta secundaria que la neutraliza con mucha más eficacia que en el caso de ausencia de vacuna (Figura 21.12). Así pues, la vacunación consigue emular el proceso natural que confiere inmunidad adquirida sin los inconvenientes que supone el padecer una primera infección y la consiguiente reacción patológica.
Las vacunas pueden obtenerse a partir de microorganismos vivos atenuados, es decir, a los que se les ha reducido artificialmente su virulencia. Estas vacunas son muy eficaces pero conllevan cierto peligro de infección patológica, sobre todo en individuos con alguna inmunodeficiencia. Otra forma de obtener vacunas es a partir de microorganismos muertos o de fragmentos de microorganismos con capacidad antigénica. Estas vacunas tienen menor capacidad inmunogénica, por lo que son menos eficaces y requieren administrar dosis de recuerdo; sin embargo, resultan más seguras, ya que no pueden dar lugar a infección patológica.
8.- TRASTORNOS DEL SISTEMA INMUNITARIO.
Aunque el sistema inmunitario específico es, dada su extraordinaria capacidad para procesar y manejar información, uno de los productos más sofisticados de la evolución biológica, en ocasiones pueden producirse fallos en su funcionamiento, que repercuten en la capacidad del organismo afectado para hacer frente a los agentes externos. Analizaremos a continuación los distintos tipos de anomalías que pueden afectar al sistema inmunitario.
-
INMUNODEFICIENCIAS.- Se trata de estados patológicos en los que el sistema inmunitario se encuentra total o parcialmente dañado de manera que no puede cumplir con sus funciones de defensa del organismo, con lo que éste resulta más vulnerable a las infecciones por agentes externos así como a procesos cancerosos. Las inmunodeficiencias pueden ser de dos tipos:
-
Congénitas (o primarias).- Obedecen a defectos hereditarios, consecuencia de mutaciones que afectan a los genes responsables del funcionamiento del sistema inmunitario (genes que codifican las inmunoglobulinas o las proteínas implicadas en su síntesis, genes que codifican los receptores de los linfocitos B y T, y otros muchos). En general se manifiestan ya en las primeras etapas de la vida, dando lugar a síndromes como los de los llamados “niños burbuja”.
-
Adquiridas (o secundarias).- Obedecen a causas externas al organismo que influyen en el desarrollo y funcionamiento de diversas estructuras relacionadas con el sistema inmunitario, como los distintos tipos de linfocitos o los órganos linfoides en los que aquéllos maduran. Una causa de este tipo de inmunodeficiencias puede ser una nutrición deficiente o escasa. Sin embargo, las inmunodeficiencias adquiridas más importantes se deben a la acción de agentes infecciosos que atacan selectivamente a las células del sistema inmunitario. Entre ellas destaca el síndrome de inmunodeficiencia adquirida (SIDA) producido por el VIH.
-
· HIPERSENSIBILIDADES.- Son estados patológicos que se producen como consecuencia de una respuesta inmunitaria de excesiva intensidad ante un antígeno de escasa peligrosidad para el organismo. Las reacciones de hipersensibilidad más comunes son conocidas como alergias. Se desencadenan ante una gran variedad de antígenos, que pueden ser de origen natural (granos de polen, heces de ácaros, diversas secreciones de los vegetales, etc.) o artificial (plásticos, metales, aditivos alimentarios, etc.). El trastorno generado por estas respuestas inmunitarias particularmente intensas es consecuencia de la reacción inflamatoria que las acompaña y sus efectos sobre los tejidos (edema, enrojecimiento, fiebre, picor, etc.).
Además de las alergias, existen reacciones de hipersensibilidad masivas que pueden acarrear la muerte del organismo afectado. Es el caso que se da a consecuencia de transfusiones de sangre entre un donante y un receptor con grupos sanguíneos incompatibles: el ataque de los anticuerpos del receptor contra los glóbulos rojos antigénicos del donante produce una coagulación masiva de la sangre (choque anafiláctico) de consecuencias fatales.
-
AUTOINMUNIDAD.- Se dan cuando un organismo desencadena una respuesta inmunitaria contra moléculas propias denominadas autoantígenos. El origen de estos fenómenos está en un error del sistema inmunitario a la hora de identificar los antígenos. Las causas de estos errores pueden ser múltiples (mutaciones en los genes del MHC, similitudes entre la conformación tridimensional de algunas zonas del autoantígeno con los epitopos de un antígeno externo previamente identificado, y otras muchas). Por regla general, los fenómenos autoinmunes se manifiestan en forma de una respuesta inmunitaria celular, con ataque de los linfocitos T citotóxicos a una determinada estirpe de células del organismo afectado.